اسید باتری معمولاً به اسید مورد استفاده در باتریهای سرب اسید اشاره دارد، اگرچه برای عملکرد هر باتری اسیدی یا سلول شیمیایی ضروری است. ذخیره انرژی شیمیایی برای استفاده نهایی الکتریکی، اصل اساسی پشت باتری ها است، از جمله باتری هایی که از اسید استفاده می کنند.
نحوه عملکرد این فرآیند الکتروشیمیایی عمدتاً به دلیل ساختار متمایز و شیمی موجود در پشت این دستگاه ها است، اما اسید باتری نیز نقش مهمی ایفا می کند.
مربوط: خرید آنلاین اسید باتری
اسید باتری از چه ساخته شده است؟
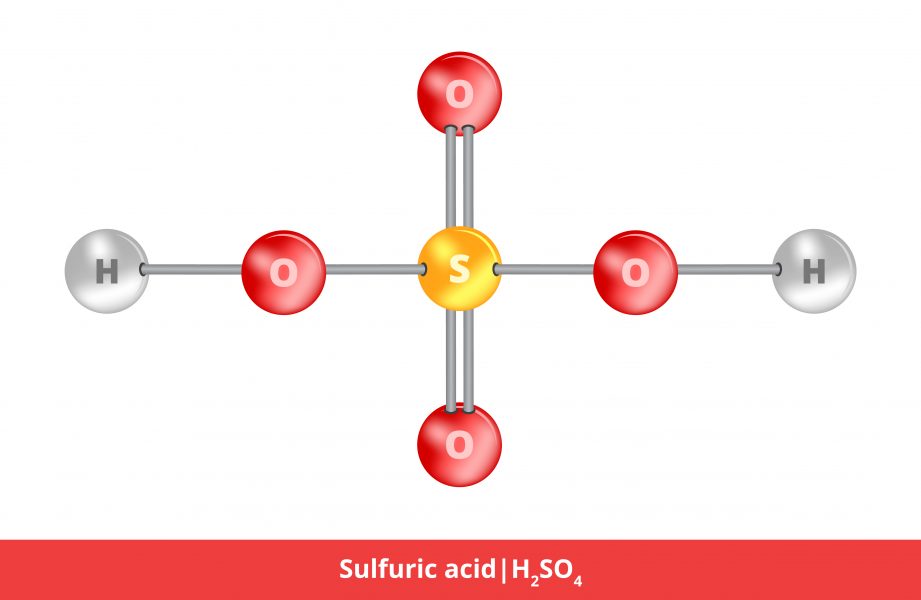
معمولاً با اشاره به نوع اسید مورد استفاده در باتری های سرب اسیدی قابل شارژ، مانند باتری های مورد استفاده در خودروها، اسید باتری از اسید سولفوریک ساخته شده است (H2بنابراین4) که با آب تصفیه شده به غلظت حدود 30-50٪ رقیق شده است. در این زمینه، اسید باتری دارای pH اسیدی 0.8 است. به همین دلیل است که باید با احتیاط رفتار شود.
باتری های سرب اسید از دو صفحه سربی رسانا به نام الکترود ساخته شده اند که با یک ماده ژل مانند چسبناک پر شده اند. در بین این صفحات محلول اسید سولفوریک رقیق شده است که به نام الکترولیت نیز شناخته می شود. بخش کلیدی دیگر باتری های سرب اسید جداکننده است که با جلوگیری از تماس مستقیم دو صفحه با یکدیگر، به عنوان یک عایق عمل می کند، چیزی که منجر به اتصال کوتاه می شود.
اسید باتری چه کاری انجام می دهد؟
به زبان ساده، اسید باتری تبدیل انرژی شیمیایی ذخیره شده به انرژی الکتریکی را تسهیل می کند. مشترک باتری معمولا از سه بخش اساسی تشکیل شده است:
- یک الکترود منفی، همچنین به عنوان شناخته شده است آند، که الکترون می فرستد به مدار خارجی این معمولا از ساخته شده است سرب اسفنجی
- یک الکترود مثبت یا کاتد، که rالکترون دریافت می کند از مدار خارجی این معمولا از ساخته شده است دی اکسید سرب
- یک الکترولیت، که اجازه می دهد هدایت یونی رخ دادن. این معمولا یک است محلول مایع از یک حلال و نمک های محلول
واکنش الکتروشیمیایی که توسط اسید باتری تسهیل میشود، به جریانی پایدار اجازه میدهد تا با ورود الکتریسیته به آند و خروج از کاتد، از طریق جفت الکترودها عبور کند.
هنگامی که یک باتری یا در حال تخلیه است یا به عنوان منبع تغذیه استفاده می شود، اسید سولفوریک موجود در الکترولیت یون های خود را به گونه ای سازماندهی می کند که غلظت کمتری داشته باشد و بیشتر شبیه H است.2O. با این اتفاق، یک سری سولفات آزاد می شود و صفحات سربی آند و کاتد را می پوشاند. این باعث کاهش ناحیه ای می شود که از آن واکنش های الکتروشیمیایی بیشتر ممکن است رخ دهد. این سطح، در حالی که دائماً یونها را منتشر میکند، با مصرف بیشتر یونهای آن، همچنان کوچکتر و کوچکتر میشود.
باتری تا زمانی که نتواند انرژی کافی را تامین کند، به کار خود ادامه می دهد، در نتیجه الکترولیت آن از یون های سولفات خالی می شود. برای اینکه دوباره کار کند، باتری باید دوباره شارژ شود، فرآیندی که اساساً واکنشی معکوس نسبت به آنچه قبلاً توضیح دادیم است.
به طور خلاصه، شارژ باتری انرژی الکتریکی را به انرژی شیمیایی تبدیل می کند، در حالی که استفاده (یا تخلیه) باتری از انرژی شیمیایی ذخیره شده با تبدیل آن به انرژی الکتریکی استفاده می کند.
چرا باتری ها حاوی اسید هستند؟
باتری ها حاوی اسید هستند زیرا برای واکنش الکتروشیمیایی که انجام می شود، اساسی است. همچنین به عنوان الکترولیت باتری شناخته می شود، اسید باتری وسیله ای است که جریان الکتریکی را بین الکترودهای مثبت و منفی حمل می کند.
با این حال، در حالی که باتری ها برای تسهیل واکنش به الکترولیت نیاز دارند، لازم نیست محلول اسید سولفوریک رقیق شده باشد. الکترولیت ها در باتری ها می توانند حلال های مخلوط با اسیدهای محلول باشند یا قلیاها و باتری های معمولی AA/AAA/D حتی حاوی الکترولیت های جامد هستند تا مایع.
اسید باتری چقدر قوی است؟
اسید باتری معمولاً دارای غلظتی در حدود 15٪ -35٪ است، اگرچه قدرت آن می تواند تا 50٪ باشد. هر غلظت اسید سولفوریک در باتری های سرب اسیدی به شدت خورنده است. استفاده نادرست از این ماده شیمیایی ممکن است منجر به کوری دائمی، سوختگی شدید، آسیب اندام های داخلی در صورت بلعیدن یا حتی مرگ شود.
اسید باتری نیز بسیار قابل اشتعال است و ممکن است در اثر حرارت یا فشار شدید مشتعل شود. در کنار این ویژگی ها، باید به ساختار شیمیایی منحصر به فرد اسید باتری و نحوه واکنش آن با مواد دیگر برای ایجاد الکتریسیته یا ذخیره انرژی شیمیایی اشاره کرد.
فرمول اسید باتری چیست؟
اسید باتری فرمول خاصی ندارد، اما معمولاً فقط از اسید سولفوریک (H) تشکیل شده است.2بنابراین4) و آب (H2O)، با سطح pH تقریبی 0.8 در غلظت 4-5 mol/L.
چقدر خفاشهry کار می کند توسط الکترون هایی که از صفحه سرب دارای بار منفی به صفحه دی اکسید سرب با بار مثبت جریان می یابند. این حرکت الکترونها باعث میشود سولفاتهای آزاد شده از اسید باتری آند را بپوشانند، که الکترونهای اضافی را به دستگاه آزاد میکند و به کاتد بازمیگردد و در نتیجه جریان الکتریکی را تسهیل میکند. فرمول این واکنش این است:
سرب (ها) + PbO2(s) + 2 H2بنابراین4(aq) → 2PbSO4(s) + 2H2O

وقتی باتری در حال استفاده است چه اتفاقی می افتد؟
آنچه در واقع هنگام استفاده از باتری اتفاق می افتد این است که یون های سولفات با بار منفی در اسید باتری به سمت الکترود منفی یعنی آند می روند. در اینجا، آنها بار منفی خود را آزاد می کنند در حالی که بقیه یون های سولفات با الکترود ترکیب می شوند و سولفات سرب را تشکیل می دهند. این فرآیند جای خود را به آزاد شدن الکترون های اضافی می دهد که از الکترود منفی خارج می شوند و به الکترود مثبت یعنی کاتد باز می گردند.
با این حال، این باعث می شود که غلظت الکترولیت در طول زمان ضعیف تر شود زیرا سولفات سرب بیشتر و آب بیشتری در محلول اسید تولید می کند. این زمانی اتفاق می افتد که هیدروژن از H جدا شود2بنابراین4 و با دی اکسید سرب موجود در کاتد واکنش می دهد که باعث افزایش غلظت آب به میزان SO بیشتر می شود4 هنگامی که باتری در حال استفاده است از یون ها برای پوشش دادن الکترود استفاده می شود. این اتفاق میافتد تا زمانی که اسید باتری بیشتر و بیشتر رقیق شود و به دلیل کمبود یونهای سولفات، توانایی آن را برای انجام واکنشهای الکتروشیمیایی بیشتر کاهش دهد.
اساساً حرکت مداوم یون ها همان چیزی است که جریان پایدار را در باتری ها ایجاد می کند. با واکنش اکسیژن در صفحه دی اکسید سرب با یون های هیدروژن برای تشکیل آب، و با واکنش سولفات جدا شده با صفحه دیگر برای تشکیل سولفات سرب بیشتر، آنچه باقی می ماند محلول اسید سولفوریک رقیق تر است که می تواند با فرآیند معکوس شارژ شود. یعنی با قرار دادن برق در آن و تبدیل آن به ذخیره شده انرژی شیمیایی.
این واکنش های الکتروشیمیایی در باتری ها بدون اسید باتری امکان پذیر نخواهد بود. با این حال، با پیشرفت مهندسی فناوری، انواع مختلف باتری در حال ظهور هستند، و نیاز به بازنگری جنبههای فنی نحوه عملکرد باتریهای رایج خودرو ضروری است تا به نوآوران اجازه داده شود تا عملکردهای بیشتری برای باتریها، با یا بدون اسید ایجاد کنند.
