واکنش های شیمیایی در مورد شکستن و ایجاد پیوند بین اتم ها است که نحوه اشتراک الکترون اتم ها را تغییر می دهد. پیوندها می توانند یونی، کووالانسی، قطبی یا فلزی باشند. پیوند ساختار مولکولی و خواص فیزیکی یک ماده را تعیین می کند. پیوند شیمیایی توسط عوامل مختلفی مانند تعداد الکترون های ظرفیت و انرژی یونیزاسیون تعیین می شود.
هنگامی که در حال تجدید نظر برای شیمی سطح A هستید، داشتن درک روشنی از اصول اساسی پیوند بسیار مهم است. شما باید بتوانید واکنش های شیمیایی را بر اساس نحوه جفت شدن مواد با یکدیگر، که با پیوند یا اشتراک الکترون ها تعیین می شود، پیش بینی کنید. اگر مفاهیم اوربیتال ها، سطوح انرژی و الکترونگاتیوی را بدانید، قادر به انجام این کار خواهید بود.
پیوند شیمیایی چیست؟
پیوند شیمیایی یک جاذبه طولانی مدت بین اتم ها، یون ها یا مولکول ها است که منجر به ایجاد ترکیبات شیمیایی متمایز و پایدار می شود. پیوندهای شیمیایی می توانند به روش های مختلفی تشکیل شوند، مانند نیروی جاذبه الکترواستاتیکی بین یون هایی که بارهای مخالف دارند، که پیوندهای یونی و ساختارهای کریستالی ترکیبات نمکی را تشکیل می دهند. پیوندها همچنین می توانند از طریق اشتراک مساوی یا تقریباً مساوی الکترون ها بین اتم ها ایجاد شوند که به پیوند کووالانسی معروف است.
استحکام باند بسته به نوع اتصال متفاوت است. به عنوان مثال، پیوندهای یونی قوی تر از پیوندهای کووالانسی هستند زیرا الکترونگاتیوی از اتم ها به طور مشابه، پیوندهای اولیه، مانند پیوندهای کووالانسی، قوی تر از پیوندهای ثانویه هستند، مانند برهمکنش های دوقطبی-دوقطبی و نیروی پراکندگی لندن. اوراق قرضه ثانویه اوراق بادوام یا پایدار نیستند.
پیوند شیمیایی شامل حداقل دو اتم از عناصر مشابه یا متفاوت است که یک مولکول یا یک ترکیب را تشکیل می دهند. به عنوان مثال، نیتروژن در طبیعت به عنوان یک مولکول متشکل از دو اتم از یک عنصر وجود دارد که دارای پیوندهای کووالانسی سه گانه است. در این نوع پیوند، الکترون ها به طور مطلق به طور مساوی تقسیم می شوند. در سایر پیوندهای کووالانسی، الکترونها کمی به اتمهایی با الکترونگاتیوی قویتر نزدیکتر هستند.
اصول اولیه باندینگ چیست؟
هنگامی که در حال تجدید نظر در شیمی فیزیکی پیوند برای سطح A هستید، لازم است ابتدا اصول اساسی پشت آن را به خوبی درک کنید. به عنوان مثال، یک اصل اصلی در پیوندهای شیمیایی، الکترونگاتیوی است. الکترونگاتیوی روشی برای اندازه گیری قدرت یک اتم از نظر جذب الکترون برای پیوند نسبت به اتم های دیگر است.
الکترونگاتیوی
شما به راحتی می توانید الگوی نحوه چیدمان عناصر را در جدول تناوبی مشاهده کنید. لینوس پاولینگ، برنده دو بار جایزه نوبل، مفهوم الکترونگاتیوی را معرفی کرد. او مقدار کمی کمتر از 1.0 برای فلزات قلیایی و حداکثر مقدار 4.0 برای فلوئور اختصاص داد:
همانطور که در تصویر می بینید، مقادیر الکترونگاتیوی عناصر از چپ به راست افزایش می یابد. در همین حال، مقادیر در یک گروه از عناصر از بالا به پایین کاهش می یابد. فلزات قلیایی و فلزات قلیایی خاکی تمایل به از دست دادن الکترون دارند و در نتیجه آرایش الکترونی یک گاز بی اثر را به دست می آورند.
بنابراین، عناصر گروه I و II کمترین اتم الکترونگاتیو را دارند. این عناصر در واقع به عنوان الکتروپوزیتیو در نظر گرفته می شوند. در طرف دیگر جدول تناوبی، هالوژن ها، متعلق به گروه VII، تمایل شدیدی برای به دست آوردن الکترون دارند و در یک پیکربندی گاز بی اثر قرار می گیرند.
ساختار الکترونی
پیکربندی الکترون توزیع الکترون ها در یک اتم در بین اوربیتال های آن است. این در تعیین پیوندهای شیمیایی احتمالی مهم است.
پیکربندی الکترونی عناصر معمولا بر اساس گروه بندی و عناصر قبلی در گروه نوشته می شود. این برای به حداقل رساندن فضا ضروری است. به عنوان مثال، پیکربندی الکترونی زنون را می توان به عنوان ادامه پیکربندی الکترونی کریپتون نوشت:
[Kr] 4d¹⁰5s²5p6
بدون نشان دادن کریپتون، پیکربندی کامل الکترون زنون را می توان به صورت زیر نوشت:
1s2 2 ثانیه2 2p6 3s2 3p6 3 بعدی10 4s2 4p6 4d10 5 ثانیه2 5p6
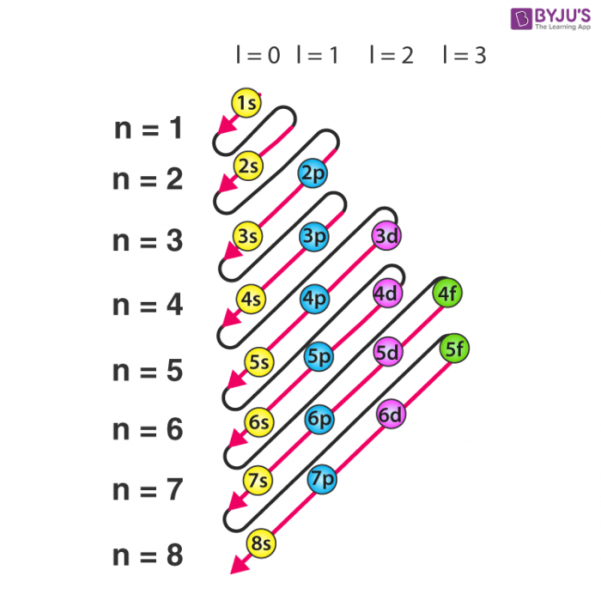
برای نوشتن می توانید از یک دستگاه یادگاری مانند تصویر زیر استفاده کنید ساختار الکترونی یک عنصر:
پیکربندی الکترونی یک عنصر برای اهداف زیر بسیار مفید است:
- تو می توانی تعیین ظرفیت یک عنصر یا چند الکترون در لایه بیرونی آن وجود دارد. این در پیوند شیمیایی بسیار مهم است
- تو می توانی پیش بینی خواص شیمیایی و فیزیکی گروهی از عناصر عناصر با پیکربندی الکترونی مشابه خواص مشابهی دارند. نمونه موردی: گازهای نجیب بی اثر
- تو می توانی از پیکربندی برای تفسیر و تجزیه و تحلیل طیف استفاده کنید منتشر شده توسط عناصر
قانون هشت
وقتی صحبت از پیوند شیمیایی به میان می آید، بیشتر عناصر از آن پیروی می کنند قانون هشتگانه. این بدان معناست که برای اینکه اتم یک عنصر با اتم دیگری از عنصر دیگر پیوند برقرار کند، باید با هشت الکترون ظرفیتی تماس داشته باشد. این پوسته ظرفیت را دقیقاً پر می کند و در نتیجه یک پیوند پایدار ایجاد می کند.
پر کردن لایه های ظرفیت با هشت الکترون باعث می شود اتم پایدار و غیر واکنشی باشد. به همین دلیل است که گازهای نجیب بی اثر هستند. این گازها نیازی به انتقال الکترون یا دریافت الکترون ندارند. در مقابل، فلزات قلیایی بسیار واکنش پذیر هستند زیرا فقط یک الکترون ظرفیت در لایه بیرونی خود دارند.
انواع باندینگ چیست؟
چهار نوع پیوند شیمیایی وجود دارد: پیوندهای یونی، پیوندهای کووالانسی، پیوندهای قطبی و پیوندهای هیدروژنی.
این نوع پیوندها از نظر استحکام متفاوت هستند و ساختارهای مولکولی که تشکیل می دهند نیز متفاوت است. در نتیجه، خواص شیمیایی و خصوصیات فیزیکی ترکیباتی که تشکیل می دهند تا حد زیادی بر اساس نوع پیوندها است.
- پیوند یونی: این تمایل به قوی ترین پیوند به دلیل وجود دارد جاذبه کولمبی بین یون های دارای بار مخالف این نوع پیوند کاملاً نامتقارن است زیرا یک یون تمام الکترون های ظرفیت را دریافت می کند در حالی که یون دیگر از الکترون های ظرفیت خود جدا می شود. استحکام پیوند مستقیماً به اختلاف بار یونها بستگی دارد. نمک ها و مواد معدنی دارای پیوند یونی هستند.
- پیوند کووالانسی: این شامل به اشتراک گذاری الکترون های ظرفیت است. با این حال، اشتراک کاملاً متقارن نیست، به جز اتمهای همان عنصر که مولکولهایی مانند مولکولهای نیتروژن را تشکیل میدهند. اکثر عناصر هنگام تشکیل پیوندهای کووالانسی از قانون هشتگانه پیروی می کنند.
- پیوند قطبی: پیوندهای قطبی نوعی پیوند کووالانسی در اتمها با الکترونگاتیوهای متفاوت هستند. این منجر به توزیع کمی نامتعادل هزینه ها می شود. در نتیجه، بخش هایی از مولکول یا کمی مثبت یا کمی منفی هستند. یکی از ساده ترین و رایج ترین مواد با پیوندهای قطبی آب است.
- پیوند هیدروژنی: این یک نوع مهم از پیوند است که نقش ویژه ای در شیمی آلی و بیوشیمی دارد. در فرآیندهای مختلف موجودات بیولوژیکی، مانند تعیین شکل مولکولهای DNA، بسیار مهم است. آب را به یک حلال عالی برای بسیاری از موادی که برای زندگی ضروری هستند تبدیل می کند. این یک نوع نیروی بین مولکولی است که یک جاذبه دوقطبی-دوقطبی ویژه یک اتم هیدروژن را با یک اتم به شدت الکترونگاتیو در نزدیکی اتم الکترونگاتیو دیگری که دارای یک جفت الکترون است، تشکیل میدهد.